初三化学气体制取原理小结
[导读] 二、发生原理 气体的发生主要考虑两大因素:反应物状态和反应条件。初中可分以下两种类型: 反应物 状态 反应 条件 反应 类型 发生 装置 举例 固体 加热 固体加热制气体 A 1.加热高锰酸钾制氧气 2.加热二氧化锰和氯酸钾制
一、反应原理
反应原理主要考虑反应能否进行、反应的快慢、生成物的纯净以及原料的价格等。
1.制取氧气:采用的是含氧化合物分解的方法。常用的药品是过氧化氢溶液、高锰酸钾、氯酸钾和二氧化锰。
2.制取二氧化碳:采用的碳酸盐和酸发生复分解反应的方法。实验室中用块状大理石(石灰石)和稀盐酸两种药品。碳酸盐不宜采用碳酸钠,因为它颗粒细小和酸反应速度过快;酸不宜采用硫酸,因为反应生成微溶的硫酸钙覆盖在固体表面使反应很难继续进行,也不宜采用浓盐酸,因为挥发性太强使二氧中有较多的氯化氢气体而不纯。
3.制取氢气:采用的是活泼金属和酸发生置换反应的方法。实验室常用锌和稀硫酸。酸不用硝酸和浓硫酸等氧化性酸,没有氢气生成;也不用盐酸,收集的气体含有杂质;金属不用镁、铝,活动性强反应速度过快;也不用铁,活动性弱反应太慢。
二、发生原理
气体的发生主要考虑两大因素:反应物状态和反应条件。初中可分以下两种类型:
反应物
状态
反应
条件
反应
类型
发生
装置
举例
固体
加热
固体加热制气体
A
1.加热高锰酸钾制氧气
2.加热二氧化锰和氯酸钾制氧气
固体、液体
常温
固体和液体常温制气体
B
1.过氧化氢溶液和二氧化锰制氧气
2.碳酸钙和稀盐酸制二氧化碳
3.锌和稀硫酸制氧气
三、收集原理
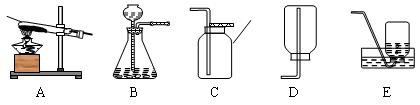
气体的收集也主要考虑两大因素:密度(与空气比较)和溶解性。同时要考虑气体的化学性质以及毒性。
密度(与空气比较) 溶解性 是否与水反应 是否与空气 中成分反应 毒性 收集方法 收集 装置 举例 大 否 无 向上排空气法 C O2、CO2 小 否 无 向下排空气法 D H2 小 否 有 排水法 E O2、 H2
四、验满原理
排水法因为可以通过观察集气瓶里水位的下降便知晓气体收集是否已满,因而不需验满。排空气法可以利用气体各自的性质来实验,但要注意位置在瓶口。
五、放置原理
主要由气体密度决定:密度比空气大的用玻璃片盖住正放于桌面;密度比空气小的用玻璃片盖住倒放于桌面。
六、步骤原理
制取气体首先组装好气体发生装置,第一步先检查装置的气密性,接着装药品,若只是固体物质,一次性装好后再固定装置;若是固体和液体两种,一般先装固体,安装好后从长颈漏斗加液体。开始反应排尽空气后收集。结束时要考虑仪器的安全。
上一篇:自然界的水知识概述
